 Detaljnija ispitivanja vodikova spektra, a posebice atoma s većim brojem
elektrona pokazala su da je Bohrov model prejednostavan jer se njime
ne može objasniti fina struktura spektralnih linija niti utjecaj električnog
i magnetskog polja na linijski spektar.
Detaljnija ispitivanja vodikova spektra, a posebice atoma s većim brojem
elektrona pokazala su da je Bohrov model prejednostavan jer se njime
ne može objasniti fina struktura spektralnih linija niti utjecaj električnog
i magnetskog polja na linijski spektar.
 Moment količine gibanja atoma, uz energiju, jedna je od najvažnijih
osobina pa je potrebno uvesti kvantni broj za njegovo opisivanje.
Moment količine gibanja atoma, uz energiju, jedna je od najvažnijih
osobina pa je potrebno uvesti kvantni broj za njegovo opisivanje.
 U klasičnoj mehanici moment količine gibanja čestice koja se giba po
kružnici brzinom v: L=mrv
U klasičnoj mehanici moment količine gibanja čestice koja se giba po
kružnici brzinom v: L=mrv
 Još je Bohr u svom modelu kvantizirao moment količine
gibanja relacijom: L=nh.
Još je Bohr u svom modelu kvantizirao moment količine
gibanja relacijom: L=nh.
 Kasniji razvoj kvantne fizike i valne mehanike pokazao je da kvantizacija
momenta količine gibanja elektrona u vodikovom atomu se ne može sasvim
dobro opisati Bohrovim modelom te je uveden orbitalni kvantni broj l.
Kasniji razvoj kvantne fizike i valne mehanike pokazao je da kvantizacija
momenta količine gibanja elektrona u vodikovom atomu se ne može sasvim
dobro opisati Bohrovim modelom te je uveden orbitalni kvantni broj l.
 Točnu
ovisnost možemo dobiti jedino rješavanjem Schrodingerove jednadžbe za
vodikov atom.
Točnu
ovisnost možemo dobiti jedino rješavanjem Schrodingerove jednadžbe za
vodikov atom.
 Tako
slijedi:
Tako
slijedi:
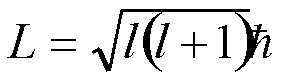 , gdje
je l kvantni broj i može poprimiti vrijednosti: l=0,1,2,3,...,n-1.
, gdje
je l kvantni broj i može poprimiti vrijednosti: l=0,1,2,3,...,n-1.
 Za
dani glavni kvantni broj n
postoji n vrijednosti orbitalnog kvantnog broja l, odnosno n mogućih
vrijednosti momenta količine gibanja L.
Za
dani glavni kvantni broj n
postoji n vrijednosti orbitalnog kvantnog broja l, odnosno n mogućih
vrijednosti momenta količine gibanja L.